Jotta jatkossa olisi helpompi ymmärtää miten ympäristö voi vaikuttaa sikiönkehitykseen,
meidän on hyvä tietää jotain epigenetiikasta. Epigenetiikka on yhä tutumpi
termi muuallakin kuin genetiikan laboratorioissa. Siitä on lukuisia
määritelmiä, joista ehkä tunnetuimpia ovat englantilaisen molekyylibiologin Robin Hollidayn ja amerikkalaisen geenitutkijan Arthur Riggsin. Hollidayn melko
suurpiirteisen määritelmän mukaan epigenetiikassa tutkitaan ajallista ja
paikallista geenien toiminnan säätelyä yksilönkehityksen aikana. Eli
esimerkiksi sitä, miten kantasolusta kehittyy erilaistumisen seurauksena
maksasolu maksaan. Riggsin tiukemman määritelmän mukaan epigenetiikassa
tutkitaan mitoottisesti eli emosolulta tytärsoluille tai meioottisesti eli
sukusoluissa sukupolvelta toiselle periytyvää
geenin toiminnan muutosta, joka ei johdu muutoksesta itse DNA-juosteessa.
Hollidayn määritelmä on kehitysbiologiaa
ja epigenetiikka mielletään osana solujen normaalia erilaistumista kehityksen
aikana. Riggs puolestaan painottaa muutoksen perinnöllisyyttä ja määritelmä tuo
mieleen lääketieteellisemmän näkemyksen: epigeneettinen muutos muuttaa geenin
toimintaa ja perinnöllisenä se voi vaikuttaa yksilön tai useamman terveyteen. Yhteistä
näille määritelmille on se, että geenien toiminta muuttuu ilman muutosta
DNA-juosteessa. Epigenetiikassa tutkitaan siis geenien säätelyä. Mutta mikä
sitten on se geenien toimintaa säätelevä kerros DNA-juosteen päällä?
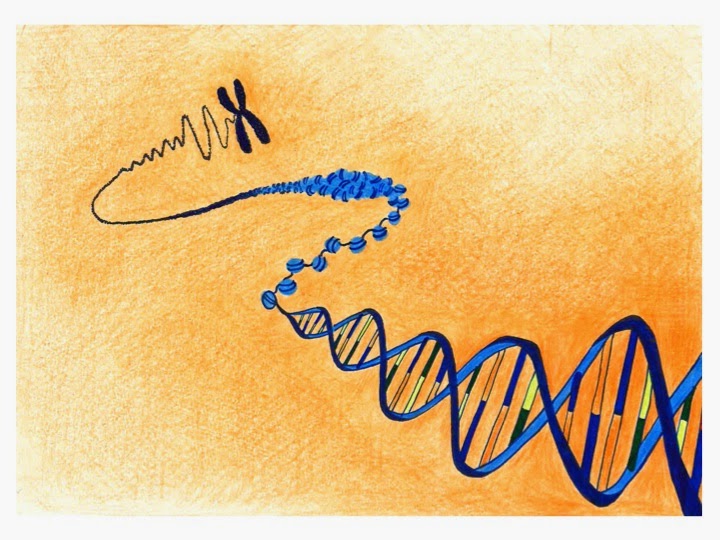
Epigenomi säätelee
geenien toimintaa
DNA-juosteen päällä on
epigenomi, ja sen tarkastelu kannattaa aloittaa histoniproteiineista. Histonit
ovat pakanneet DNA-juosteen soluihimme. Ottaen huomioon juosteen pituuden ja
solujen koon, ovat nämä “ahtaajat” tehtävässään erittäin tehokkaita ja järjestelmällisiä.
DNA-juoste ja histoniproteiinit muodostavat yhdessä kromatiinin, joka
tiiviimmillään nähdään solujen jakautuessa X:n mallisina kromosomeina.
Kromatiinin ollessa tiukkaa, ei geenien toimintaan tarvittavat molekyylit pääse
kiinnittymään DNA-juosteeseen ja geenit ovat hiljentyneet. Aktiivisesti
toimivien geenien kohdalla kromatiini on löysää.
Se kuinka löysää tai
tiukkaa kromatiini on, riippuu histoneihin kiinnittyvistä molekyyleistä. Nämä
molekyylit ovat keskeinen osa epigeneettistä säätelyä. Tähän mennessä on
löydetty lukuisia erilaisia histonien häntiin kiinnittyviä molekyylejä ja
lukumäärä kasvaa.
Epigeneettisistä merkeistä eniten on kuitenkin tutkittu DNA-metylaatiota. Yksinkertaisimmillaan metyyliryhmä istahtaa geenin säätelyalueelle, estää geenin toimintaan tarvittavan säätelytekijän sitoutumisen ja hiljentää geenin. Tämän suoran vaikutuksen lisäksi metyloituneeseen DNA-juosteeseen voi kiinnittyä proteiineja, jotka muokkaavat histonien häntiä ja näin muuttavat kohdan kromatiinin rakennetta.
Epigeneettisistä merkeistä eniten on kuitenkin tutkittu DNA-metylaatiota. Yksinkertaisimmillaan metyyliryhmä istahtaa geenin säätelyalueelle, estää geenin toimintaan tarvittavan säätelytekijän sitoutumisen ja hiljentää geenin. Tämän suoran vaikutuksen lisäksi metyloituneeseen DNA-juosteeseen voi kiinnittyä proteiineja, jotka muokkaavat histonien häntiä ja näin muuttavat kohdan kromatiinin rakennetta.
DNA-metylaation ja
histoneita muokkaavien molekyylien lisäksi geenien toimintaa säätelee pienet
RNA:n pätkät, mikroRNAt. Ne voivat vaikuttaa suoraan geenien tuottaman
proteiinin määrään hajottamalla geenien tuotetta. Lisäksi muu epigeneettinen
säätely voi vaikuttaa niiden luentaan DNA-juosteesta ja sitä kautta määrään
solussa.
Nämä kolme parhaiten
tunnettua epigeneettistä säätelytekijää kuuluvat epigenomiin. Epigenomilla on
tärkeä rooli sikiönkehityksessä: se säätelee solujen erilaistumista. Yhdestä
hedelmöittyneestä munasolusta kehittyy yli 200 erilaista solutyyppiä, joilla
jokaisella on samanlainen DNA-juoste, mutta omanlaisensa epigeettinen profiili.
Maksasolussa toimivat aktiivisesti solun elämää ylläpitävien geenien lisäksi
juuri maksasolujen toiminnalle tarpeelliset geenit. Näiden geenien kohdalla
kromatiini on siis löysää. Toisaalta nämä samaiset kohdat kromatiinia ovat
tiukasti pakattuina hermosoluissa, joissa juuri näiden geenien tuottamaa
proteiinia ei tarvita.
Tutkimusten mukaan ympäristö
voi muuttaa näitä epigeneettisiä merkkejä ja vaikuttaa näin geenien toimintaan.
Tätä tutkitaan ympäristöepigenetiikassa. Epigeneettisiä merkkejä tulee lisää ja
niitä häviää meiltä jokaiselta elämämme aikana. Muutos niissä voi olla
esimerkiksi syövän kehityksessä se ratkaiseva askel, joka johtaa solujen
villiintyneeseen jakautumiseen ja kasvaimeen. Solu- ja eläinkokeet ovat
osoittaneet, että epigenomi olisi haavoittuvimmillaan ympäristön vaikutuksille
juuri alkuraskauden aikana. Solujen epigeneettiset profiilit muodostuvat ja
kopioituvat tytärsoluille. Maksasoluista tulee jakautuessa maksasoluja ja
hermosoluista hermosoluja. Väärään paikkaan istahtava metyyliryhmä epigenomin
muodostuessa voi siis lähteä jakautumisien myötä siirtymään tytärsoluihin ja
edelleen tytärsoluihin, ja jäädä näin soluihin loppuelämäksi. Ja pahimmillaan
estää jonkin geenin normaalin toiminnan.
Folaattia hermoston
kehitykseen
Ravinnosta saatava folaatti
eli vesiliukoinen B9-vitamiini sekä sen synteettinen muoto foolihappo ovat
tärkeitä metyyliryhmien lähteitä DNA-juostetta ja histoniproteiineja
metyloitaessa. Lisäksi sitä tarvitaan uuden DNA-juosteen valmistukseen. Ei siis
yllätä, että sen puutos raskauden alussa voi aiheuttaa vakavia kehityshäiriöitä
kuten spina bifidaa, yhtä yleisimmistä synnynnäisitä epämuodostumista.
Häiriössä hermostoputki ei sulkeudukaan normaalisti sikiönkehityksen alussa.
Tämä aiheuttaa pahimmillaan syntyvälle lapselle alavartaloon hermostollisia
häiriöitä, osittaista halvaantumista ja häiriöitä aivojen toiminnassa kuten
kognitiossa. Terveyden ja hyvinvoinnin laitoksen epämuodostumarekisterin mukaan
Suomessa syntyy vuosittain 40-50 lasta, joilla on hermostoputken
sulkeutumishäiriö. Sille altistaa sekä perinnölliset tekijät että ympäristö.
Yhteys vähäisen folaatin
ja hermostoputken sulkeutumishäiriöiden välillä näyttää selvältä. Esimerkiksi Yhdysvalloissa
ja Kanadassa foolihapon lisäminen jauhoihin vähensi häiriöitä merkittävästi.
Foolihapon on myös osoitettu vaikuttavan raskauden aikana sikiön epigenomiin, sekä
hiirillä että ihmisillä. Vielä
ei kuitenkaan tiedetä miten liian vähäinen folaatin määrä vaikuttaisi epigenomiin,
hermoston kehitykselle oleellisten geenien toimintaan ja aiheuttaisi hermostoputken
sulkeutumishäiriön. Vai onko kyseessä kuitenkin jokin muu mekanismi? Tutkimustulokset
ovat ristiriitaisia, eikä selvää yhteyttä folaattiannoksen, epigeneettisten
muutosten ja spina bifidan välillä ole vielä löydetty. Hyvinkin erilaisissa
tutkimuksissa on tarkasteltu pieniä alueita epigenomissa, joten laajamittainen,
koko epigenomin kattava tutkimus olisi tarpeen.
Monissa maissa suositellaan
odottaville äideille foolihappolisää. Näin myös Australiassa, missä yksi
lapsistamme syntyi. Lisän ottaminen piti suositusten mukaan aloittaa vähintään
kolme kuukautta ennen hedelmöitystä. Sitä tuli ottaa ainakin alkuraskauden
ajan, mutta mieluiten läpi koko raskauden. En muista, että neuvolassa täällä Suomessa olisi puhuttu meille säännöllisestä foolihappolisästä. Suhtauduinkin aluksi Australian suosituksiin
epäluuloisesti. Tuntui vähintäänkin erikoiselta, että tutkimustiedot, jotka Australiassa olivat johtaneet näinkin tavanomaiseksi rutiiniksi, eivät olleet
kantautuneet meidän huippuluokan neuvolajärjestelmän ja terveydenhuollon
korviin. Söin kyllä lisäni aina kun muistin. Kasvissyöjänä en kuitenkaan osannut
olla asiasta sen kummemmin huolissani, koska folaatin tärkeimpiä lähteitä ovat vihreät
vihannekset. Lisäksi sitä saa täysjyväviljasta, hedelmistä, marjoista,
pähkinöistä, kananmunista ja lihasta.
Huomasin, että
Suomessakin on viralliset suositukset. Vuoden 2014 Terveyttä ruoasta! -ravitsemussuosituksen
mukaan odottavan tai imettävän äidin tulisi saada folaattia 500 mikrogrammaa
vuorokaudessa. Koska suomalainen ei-raskaana oleva nainen saa ravinnosta
keskimäärin hieman alle suosituksen eli alle 300 mikrogrammaa folaattia
vuorokaudessa, raskautta suunnittelevan tai jo odottavan on syytä miettiä
lisiä. Tai ainakin tarkistaa ruokavalio.
Kertokaa, jos tiedätte
suosituksista enemmän!